Vivant
La spectroscopie à molécule unique ouvre l’ère de la médecine personnalisée
- Tweeter
-
-
1 avis :
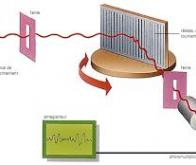
Pour observer le spectre vibrationnel infrarouge d’une seule protéine, on utilise des outils de mesures avancées, basées sur la microscopie optique en champ proche. Cette méthode utilise la lumière confinée à l’échelle nanométrique, permettant l’analyse détaillée d’échantillons extrêmement petits, ce qui représentait auparavant un défi avec la spectroscopie infrarouge conventionnelle. Cette réalisation représente une avancée majeure vers des innovations technologiques telles que l’imagerie infrarouge ultra-sensible et super-résolution, ainsi que la spectroscopie vibrationnelle d’une seule molécule.
La spectroscopie infrarouge est largement utilisée pour l’analyse structurelle et chimique de divers matériaux, car elle peut mesurer des spectres vibrationnels, souvent appelés "empreintes moléculaires". Le développement rapide de la nanotechnologie ces dernières années a conduit à une demande croissante d’imagerie infrarouge à ultra-haute sensibilité et à super-résolution. Cependant, la spectroscopie infrarouge conventionnelle est limitée dans la mesure d’échantillons extrêmement petits ou dans l’obtention d’une résolution spatiale à l’échelle nanométrique. Par exemple, même la microspectroscopie infrarouge avec une bonne sensibilité nécessite plus d’un million de protéines pour obtenir un spectre infrarouge, ce qui rend impossible la mesure d’une seule protéine.
Une équipe de recherche interdisciplinaire, dirigée par Jun Nishida (professeur adjoint) et Takashi Kumagai (professeur associé) de l’Institut des sciences moléculaires, a observé avec succès les spectres vibrationnels de protéines uniques, constitués d’environ 500 résidus d’acides aminés, en utilisant des techniques de mesures avancées basées sur la microscopie optique en champ proche.
Dans son étude, l’équipe de recherche a isolé une seule protéine, une sous-unité comprenant un complexe protéique appelé F.1-ATPase, sur un substrat en or, et réalisé des mesures de spectroscopie infrarouge en champ proche dans un environnement ambiant. Elle a réussi à acquérir le spectre vibrationnel infrarouge d’une seule protéine, ce qui représente une avancée majeure qui pourrait conduire à la caractérisation des organisations structurelles locales de protéines individuelles. Ces informations sont particulièrement importantes pour comprendre les fonctions sophistiquées des complexes protéiques et des protéines membranaires, offrant ainsi une compréhension plus approfondie de leurs mécanismes et interactions. En outre, les chercheurs ont développé un nouveau cadre théorique décrivant les interactions à l’échelle nanométrique entre le champ proche infrarouge et les protéines. Sur la base de cette théorie, l’équipe a pu reproduire quantitativement les spectres vibrationnels expérimentaux observés. Ces résultats seront inestimables pour l’analyse chimique de biomolécules ainsi que de divers nanomatériaux, ouvrant la voie à une gamme d’applications de spectroscopie infrarouge à l’échelle nanométrique.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :

Un robot vidéo pour dépister le cancer gastrique à Nantes
En apparence, c’est une petite gélule que l’on avale. Sauf que ce comprimé est équipé d’un mini-robot, avec une caméra miniature (grand angle de 180°), chargé d’explorer en détail votre tube ...

Le CHU de Montpellier fait le choix de l'IA
L'IA peut-elle aider les soignants, les chercheurs et le personnel administratif du CHU de Montpellier ? Peut-elle leur permettre d’améliorer leurs pratiques en les soulageant de nombreuses ...
DMLA : la luminothérapie ouvre un nouvel espoir thérapeutique
Première cause de handicap visuel chez les plus de 50 ans, la dégénérescence maculaire liée à l'âge (DMLA) est une maladie chronique de la zone centrale de la rétine, appelée macula. Sa forme la ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Médecine
- Partager :