Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Vers un poropeptide chasseur-tueur de cancer
- Tweeter
-
-
0 avis :
Des chercheurs de l’Institut de Biologie et Chimie des Protéines (CNRS/Université Lyon 1) ont conçu une molécule qui perfore les mitochondries centrales énergétiques de toute cellule, donc des cellules cancereuses. Les chercheurs se sont inspirés d’une protéine naturelle qui a le même rôle. Le cancer consiste dans la prolifération de cellules (tumorales) qui ne meurent pas alors que les cellules « normales » sont programmées pour mourir. Une des voies de recherche pour lutter contre des tumeurs, consiste à provoquer la mort des cellules tumorales non pas par des agents chimiques ou autres, mais en activant des mécanismes biologiques.
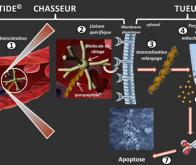
C’est cette voie prometteuse qu'a suivie l’équipe-projet POROS de l’Institut de Biologie et Chimie des Protéines (IBCP) de Lyon et leurs travaux ont débouché sur un brevet et une publication dans la revue Journal of Cell Science le 18 janvier. Les « peptides tueurs » capables de déstabiliser les membranes biologiques ont été dérivés d’une protéine de mort cellulaire appartenant à une famille de régulateurs exerçant leur action au niveau de la mitochondrie.
Les chercheurs ont montré que de tels fragments peptidiques pouvaient, en altérant directement l’intégrité des membranes mitochondriales, induire la libération de cytochrome c à partir de mitochondries purifiées. Ce mécanisme de perforation des mitochondries conduit irrémédiablement à la mort des cellules. Un peptide synthétique particulièrement actif au niveau membranaire peut déclencher le suicide de cellules tumorales cultivées in vitro. Des expériences in vivo ont montré que ce peptide avait un puissant effet anticancéreux dans un modèle implanté chez des souris atteintes de tumeurs du sein.
Ce poropeptide tueur fait partie d’une des familles les plus originales d’agents anticancéreux récemment découvertes. Il apparait comme une alternative aux peptides artificiels. Les peptides thérapeutiques sont mieux tolérés et s'éliminent plus facilement que les drogues conventionnelles, ce qui permet de limiter les inconvénients liés au traitement. Il reste beaucoup à faire avant d’arriver à une molécule utilisable en thérapie. Il faut réduire la taille de la molécule et savoir l’adresser pour qu’elle n’aille détruire que les cellules des tumeurs et non les tissus sains. Les conjugués « chasseurs-tueurs » ainsi fabriqués seront capables de naviguer dans le sang, de reconnaître le site tumoral, d’être internalisés et d’induire la mort des cellules.
Noter cet article :
Vous serez certainement intéressé par ces articles :

Un médicament contre l’arthrite repositionné contre l'épilepsie
Un médicament contre l’arthrite pourrait-il soulager durablement l’épilepsie et réduire les crises ? C’est ce que suggère cette équipe de neurologues de l’Université du Wisconsin-Madison, qui ...

La sensibilité à l’alimentation transformée varie d’une personne à l’autre en fonction du microbiote de chacun
Des scientifiques français de l'Inserm ont réussi à montrer que la sensibilité à un additif alimentaire très utilisé, qui favorise l’inflammation intestinale chronique, varie d’une personne à ...
Prédire grâce à l'IA le rôle des mutations génétiques complexes
Des scientifiques de l’Institute of Science and Technology Austria (ISTA), à Klosterneuburg, en Autriche, proposent un nouveau cadre plus global et plus durable pour étudier les maladies ...
Recommander cet article :
- Nombre de consultations : 177
- Publié dans : Biologie & Biochimie
- Partager :